La montée
La montée des blancs en neige est la première étape dans la préparation
de l'île flottante. Cette technique de cuisine est sans doute celle que l'on maîtrise
le mieux depuis notre enfance. En effet, à première vue, rien de
compliqué : il nous faut un fouet, un blanc d'œuf, et un saladier. Cependant nous ne nous en lassons jamais. En effet, comment une substance visqueuse et transparente peut-elle se transformer en une merveille de mousse d'un blanc éclatant ?
Cette transformation est l'aboutissement de deux processus : la dénaturation des protéines et la tensioactivité.
Commençons par expliquer ce que c'est : une mousse c'est-à-dire une dispersion de gaz, dans un
liquide ou un solide, actionnée par le fouet qui incorpore des bulles d'air au
blanc d'oeuf, les divisant en une taille de plus en plus petite.
Nous l'avons déjà présenté, le blanc d'oeuf est un mélange d'eau à 90% et 10% de protéines. L'eau ne retenant pas l'air, ce sont donc les
protéines qui sont à l'origine de cette mousse et particulièrement l'ovomucine
et la conalbumine, protéines la propriété moussante.
La dénaturation des protéines :
Les protéines, en temps normal, se recroquevillent sur elles-mêmes. Elles ont une structure tridimensionnelle. Mais clles-ci sont déformables: sous l'action du fouet, elles subissent
une dénaturation.
Schéma de la dénaturation, avant-pendant-après le fouet
Les protéines sont donc enroulées sur elles-mêmes, formant une molécule tridimensionnelle afin d’obtenir le moins de contact éventuel avec l’eau.
Les ponts disulfures et les liaisons hydrogènes forment cette stucture.
La liaison hydrogène est une interaction assez importante reliant un atome électronégatif, à un atome H (hydrogène).
Les ponts disulfures résultent de deux atomes de soufre qui se joignent.
La liaison ionique est formée par l’attraction de deux ions de signes opposés.
Quelques molécules hydrophobes ne pouvant former de liaison hydrogène se regroupent pour ne pas être en relation avec les molécules d’eau, créant ainsi l’effet hydrophobe.
Schéma de la protéine et de ses différentes interactions intramoléculaires
Revenons aux blancs : les fouets vont agir dessus et briser les liaisons faibles hydrogènes,
qui permettent le maintien de leur structure tridimensionnelle.
Elles vont alors se dérouler et
former un film qui va emprisonner les bulles d'air dans la phase liquide. Ce film emprisonne les bulles d’air alors entourées
d’une pellicule d’eau.
On distingue très clairement les pellicules de protéines qui emprisonnent les bulles d'air sur cette photographie.
Mais de quelle façon les protéines permettent la stabilité de cette mousse ?
La tensioactivité :
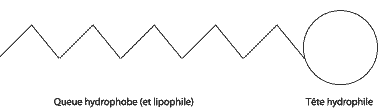
L'explication est simple : elle sont tensioactives. Un agent tensioactif est une molécule amphiphile : elles présentent une queue lipophile qui a davantage d'affinité avec les molécules grasses, et une tête hydrophile qui s'allie volontier avec l'eau. La queue lipophile est donc également hydrophobe : elle préférera le contact de l'air plutôt que celui de l'eau.
Schéma d'une molécule tensioactive
Ces préférences s'expliquent par la polarité : la tête hydrophile est tout simplement polaire. Cela veut dire que certains de ses atomes attirent plus les électrons que les autres (ils sont plus électronégatifs) et que des pôles apparaissent au sein de cette tête. Elle est donc soluble dans le solvant polaire qu'est l'eau !
Par attraction et répulsion, les protéines se forment naturellement de cette façon :
La pellicule de protéines ressemble donc à cela :
Quant aux solutions miracles, nous les avons testées, nous vous annonçons les résultats.
Indéniablement, un pincée de sel ou quelques gouttes de jus de citron diminuent notre temps de souffrance (à part si vous êtes dotés de la plus haute technologie et que vous disposez d'un batteur électrique), mais au détriment de la fermeté de notre nuage !
Ils permettent simplement d’accélérer la mise en place des protéines autour de la bulle d'air en diminuant les interactions entre la tête et la queue.
Le sel, NaCl se dissout en deux ions Cl- et Na+ qui vont chacun aller de part et d'autre de la protéine, ce qui va atténuer leur répulsion et faciliter la dénaturation et la formation de la bulle.
Le jus de citron agit de la même façon, car au contact de l'eau, et de par son acidité, il va libérer des ions.
Donc, au lieu de sacrifier la fermeté de vos blancs, nous vous proposons d'autre astuces :
choisir un fouet avec le plus de fils possible. Admettons qu'un fil introduit deux bulles par mouvement, quarante fils introduisent quatre-vingts bulles par mouvement ! Avons-nous besoin de continuer ?
choisir un fouet avec un gros manche. Cela évite la crispation du poignet, et vous permet de battre plus vite, plus longtemps !
toujours battre dans le même sens. Battre dans un sens introduit des bulles, battre dans l'autre les détruit !
y incorporer le sucre à la "mi-fouettage" (si vous nous permettez l'expression). Les incorporer après risque de casser les blancs, les incorporer avant diminue le pouvoir moussant.
éviter toute trace de jaune. Le gras du jaune attirera les molécules tensioactives davantage que l'air, de ce fait, les blancs ne monteront pas !
Conclusion
Donc, au lieu de sacrifier la fermeté de vos blancs, nous vous proposons d'autre astuces :
choisir un fouet avec le plus de fils possible. Admettons qu'un fil introduit deux bulles par mouvement, quarante fils introduisent quatre-vingts bulles par mouvement ! Avons-nous besoin de continuer ?
choisir un fouet avec un gros manche. Cela évite la crispation du poignet, et vous permet de battre plus vite, plus longtemps !
toujours battre dans le même sens. Battre dans un sens introduit des bulles, battre dans l'autre les détruit !
y incorporer le sucre à la "mi-fouettage" (si vous nous permettez l'expression). Les incorporer après risque de casser les blancs, les incorporer avant diminue le pouvoir moussant.
éviter toute trace de jaune. Le gras du jaune attirera les molécules tensioactives davantage que l'air, de ce fait, les blancs ne monteront pas !
Conclusion
Nous avons éclairé ici les deux principes de la montée des blancs en neige. Le premier, la dénaturation est le déploiement des protéines de l'oeuf, qui vont emprisonner les bulles d'air, les empêchant de s'échapper par leur pouvoir tensioactif. Ce pouvoir lui permet de se faire entendre deux éléments, ici l'eau et l'air.
Mais nous avons aussi démystifié les effets du sel et du jus de citron qui atténuent les violentes interactions au coeur des protéines.
La désintégration des
blancs en neige dans l’eau, le lait ou dans un four (à micro-ondes ou
traditionnel) est sans doute le moment le plus redouté et le cauchemar de
chaque personne qui tente l’île flottante. Voir le fruit de minutes (qui
paraissent des heures) de crispation du poignet si l’on utilise un fouet
manuel, de bruit si l’on utilise un batteur électrique, et voir cette neige si
blanche et aérienne… devenir une sorte de galette de substance blanche
douteuse, c’est sans doute l’échec le plus éprouvant dans la vie d’un cuisinier.
Cette désintégration est normale d’un point de vue
scientifique. Le blanc d’œuf, nous l’avons vu, est composé de protéines et d’eau.
Les deux sont solubles dans l’eau, donc dans le lait… Et pourtant, la cuisson des
quenelles a lieu soit dans l’un, soit dans l’autre. Il s’agit ici de les plonger dans
le liquide chaud. Donc il s’agit forcément d’un choc thermique, et non pas d’une
cuisson progressive.
De l'eau froide et des blancs en neige : désastre
C'est déjà mieux !
Serions-nous alors
en face d’une sorte de grumeau géant ? Pas tellement. En effet, la
similarité entre ces couches protectrices est présente, mais dans une quenelle
de blancs en neige, nous ne pouvons pas parler d’une différence de texture
entre l’extérieur et le cœur de la quenelle, comme on pourrait le dire pour le
grumeau farineux humide à l’extérieur et sec à l’intérieur. Certes, la
différence est peut-être là, mais ni à l’œil nu, ni au microscope nous n’observons
de différence de structure ni de texture. Très certainement, la couche saisie
par la chaleur est beaucoup trop mince pour être prélevée. En effet, nous
pouvons désigner les blancs en neige comme des fenêtres multi-vitrages :
les bulles sont très isolantes, la chaleur auraient surement du mal à se
propager jusqu’au centre des îles, ou même à un millimètre de la surface.
En tout cas, l’hypothèse d’un choc thermique est la plus
valable. D’autant plus que le four à micro-ondes est une technique de plus en
plus populaire : cette méthode de cuisson est connue pour la brutalité de
l’apport en chaleur, qui joue sensiblement un rôle dans la cuisson de ces îles.
Mais quand même,
que se passe-t-il durant cette cuisson ?
Dans notre groupe, nous avons émis plusieurs hypothèses. La
première consistait en une absorption : les quenelles se gorgeraient d’eau
ou de lait, c’est pourquoi nous les faisons cuire dans ceux-ci. Mais quand est-il des cuissons au four ?
La seconde était son exact opposé : la cuisson serait
une évaporation de l’eau contenue dans les blancs en neige. Le fait de les
plonger dans les liquides chauds permettrait seulement de créer ce choc
thermique dont nous parlions.
C’est alors que nous pouvons penser à la meringue :
blancs en neige battus exactement de la même façon que ceux des îles avec du
sucre, mais cuits au four, sans eau. Il est très souvent conseillé d’ouvrir le
four à mi-cuisson pour que la vapeur s’échappe du four. S’agirait-il alors d’une
évaporation ? Que resterait-il alors dans les meringues cuites excessivement ? Seulement
un réseau de protéines et de sucre ?
Une meringue : sorte de quenelle très cuite au four
Lors de notre expérience, nous avons remarqué sans y être
préparés que la quantité de lait dans lequel nous pochions les blancs, avait
sensiblement diminuée. Mais la masse des quenelles avait aussi diminuée après la
cuisson.
Nous pouvons alors poser la dernière hypothèse, un hybride
des deux premières : la chaleur entraine une certaine évaporation de l’eau,
qui permet une solidité et une rigidité protégeant la quenelle de la
désintégration. Mais après cette évaporation, la quenelle doit s’imbiber légèrement
d’eau.
Mais entre le lait
et l’eau, que choisir ?
L’économie préférait le lait, afin de le réutiliser juste
après, déjà chaud et parfumé pour la crème anglaise.
La tensioactivité préférerait l’eau.
En effet les molécules tensioactives de l’œuf, en tension entre l’eau et l’air sont toujours là. Et le pôle hydrophobe, celui qui est au contact de l’air, est encore davantage attiré par les molécules grasses du lait en suspension dans l’eau. Il faudrait donc choisir un lait pauvre en matière grasse, écrémé donc, plutôt à un lait entier de peur de voir ses quenelles s’aplatir.
En effet les molécules tensioactives de l’œuf, en tension entre l’eau et l’air sont toujours là. Et le pôle hydrophobe, celui qui est au contact de l’air, est encore davantage attiré par les molécules grasses du lait en suspension dans l’eau. Il faudrait donc choisir un lait pauvre en matière grasse, écrémé donc, plutôt à un lait entier de peur de voir ses quenelles s’aplatir.
Conclusion
La cuisson du blanc ne demeure pas un mystère total, les
grands principes étant quelque peu dégagés : celui du choc thermique, et
celui de l’évaporation/absorption. Cependant, la difficulté de notre TPE est
encore apparue : le sujet n’étant pas scientifique de base, et le manque
de recherches et d’études sur ce sujet nous empêchent d’aller plus loin.